 8
8
上海沙格专注于医疗器械行业,熟悉法规,海内外团队!fda510k,FDASUNGO,您值得信赖!服务有**!
Medical Devices FDA 510K 基本流程
一、FDA法规要求
按照美国食品药品监督管理局(FDA)相关规定,任何一种器械进入美国市场前,必须弄清申请产品分类和管理要求。
根据风险等级的不同,FDA将器械分为三类(Ⅰ,Ⅱ,Ⅲ),Ⅲ类风险等级高,Ⅰ类风险低。对I类产品实施一般控制(General Control);II类产品实施控制(Special Control);对III类产品实施上市前许可。
对于任何产品,企业都需进行企业注册(Registration)和产品列名(Listing)。
对Ⅰ类产品实行的是一般控制,绝大部分产品只需进行注册、列名和实施GMP规范后产品即可进入美国市场销售,其中少数产品连GMP也豁免,少数保留产品则需向FDA递交510(K)申请PMN;
对Ⅱ类产品实行的是控制,企业在进行注册和列名后,还需实施GMP和递交510(K)申请。FDA对大多数Ⅱ类产品均要求进行上市前通告(510K)。
生产企业须在产品上市前通过510K审查后,产品才能够上市销售;对Ⅲ类产品实施的是上市前许可,企业在进行注册和列名后,须实施GMP并向FDA递交PMA申请(部分Ⅲ类产品还是PMN)。
二、FDA 510K基本流程
美国FDA对流入本国并在本国上市销售的器械产品,实行严格的法规把控,510K产品在申报时必须通过FDA审查。
我公司办理欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
按照FDA要求,大部分的二类产品,少部分的一类和三类产品,进行FDA医疗器械注册前,需要先递交FDA510(K)论证报告给FDA,来论证产品本身的*性和有效性。FDA510(K)本身不是注册,是进行产品注册的前提条件;
FDA510(K)涉及到众多的FDA行政性要求,*,有效性论证等要求,申请时需要适用的测试标准,FDA法规和导则众多,通常很难由制造商和个人单完成,FDASUNGO基于我们对各类产品510K的成功受理经验和法规经验,有能力为客人510(K)申请提供撰写及相关技术支持服务;确保:
- 递交的510(K)文件的格式完整性(即510(K)文件行政性审核)
- 递交的510(K)文件的*和有效性论证的符合性(即510(K)技术审核)并尽量避免和减少FDA的审核提问
- 递交的510(K)文件的所有产品信息,测试报告等基本符合FDA认可的法规,标准和导则要求,不会有重大疏漏和错误;
- 只有FDASUNGO在审核,整理和确保所有收到的文件和信息符合FDA的法规要求后,FDASUNGO才会正式递交FDA审核,并确保顺利获批;
目前FDA已经加大FDA审核的难度和力度,任何一个510(K)申请都需要基于制造商对产品的精通和服务商对法规的精通结合才有获批可能。任何人或服务商如果诱导您以非常低廉的价格,并承诺*或只需递交很少的信息就可以获得510(K)批准,意味着您需要面临:
- 递交的510(K)内容不完整,信息虚假或论证乏力,无法通过FDA审核,终被驳回;浪费了您的费用和时间,也影响了产品尽早上市获得更多订单的可能;有时也可能导致供货违约;
- 不知情或知情的情况下违法使用其他厂商申请510(K)的文件导致触犯法律问题;
- 被FDA发现作假后可能会启动工厂和实验室审核;
- 被禁止在美国海关通关产品和要求召回产品;
- 已经获批的510(K)被取消;
- 您的客人订购您的产品时要求您提供的510K相关的测试,标签等信息您无法提供导致无法供货或违约等;
请谨慎选择有据可查的真实510(K)咨询服务商,避免因小失大。
医疗器械FDA 510(k)注册,因其相应FD&C Act*510,故通常称510(K)注册。510(k)为医疗器械在美国上市的主要途径之一,绝大多数的II类医疗器械和部分I类、III类医疗器械通过此途径清关上市。对510(k)注册文件所必须包含的信息,FDA有一个基本的要求,其内容大致如下16个方面:
1) 申请函,此部分应包括申请人(或联系人)和企业的基本信息、510(K)递交的目的、申请上市器械的名称型号和分类资料、进行实质等效比较的产品(Predicate Device)名称及其510(k)号码;
2) 目录,即510(k)文件中所含全部资料的清单(包括附件);
3) 真实性保证声明,对此声明,FDA有一个标准的样本;
4) 器材名称,即产品通用名、FDA分类名、产品贸易名;
5) 注册号码,如企业在递交510(k)时已进行企业注册,则应给出注册信息,若未注册,也予;
6) 分类,即产品的分类组、类别、管理号和产品代码;
7) 性能标准,产品所满足的强制性标准或自愿性标准;
8) 产品标识,包括企业包装标识、使用说明书、包装附件、产品标示等;
9) 实质相等性比较(SE);
10) 510(k)摘要或声明;
11) 产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等;
12) 产品的*性与有效性,包括各种设计、测试资料;
13) 生物相容性;
14) 色素添加剂(如适用);
15) 软件验证(如适用);
16) 灭菌(如适用),包括灭菌方法的描述、灭菌验证产品包装和标识等。
FDA510K 流程
实质相等性比较(SE)
实质相等性比较是要所申请上市的产品和已在美国市场上合法销售的产品在*性和有效性方面比较是实质相等的。选择合适的产品进行比较是510(K)申请的关键步骤。在进行比较时应从如下方面进行考虑:
企业必须提供充足的资料,所申请上市的器械和被比较的器械是实质相等的(SE),否则510(k)申请不会通过。
510(K)审查程序
FDA在收到企业递交的510(k)资料后,先检查资料是否齐全,如资料齐全,则受理并给企业发出确认性,同时给出申请受理编号(K YYXXXX),此号码也将作为正式批准后的号码;如不齐全,则要求企业在规定时间内补充齐全,否则作企业放弃处理。FDA在受理申请后即进入内部工作程序,其中可能还会要求企业补充一些资料。在510(k)申请通过审阅后,FDA并不立即发出批准函件,而是根据产品风险等级、市场先前是否对企业有不良反 映等确定是否对企业进行现场GMP考核,考核通过后再发给企业正式批准函件(Clearance);如无须现场考核GMP,则510(k)申请通过后立即发给正式批准函件。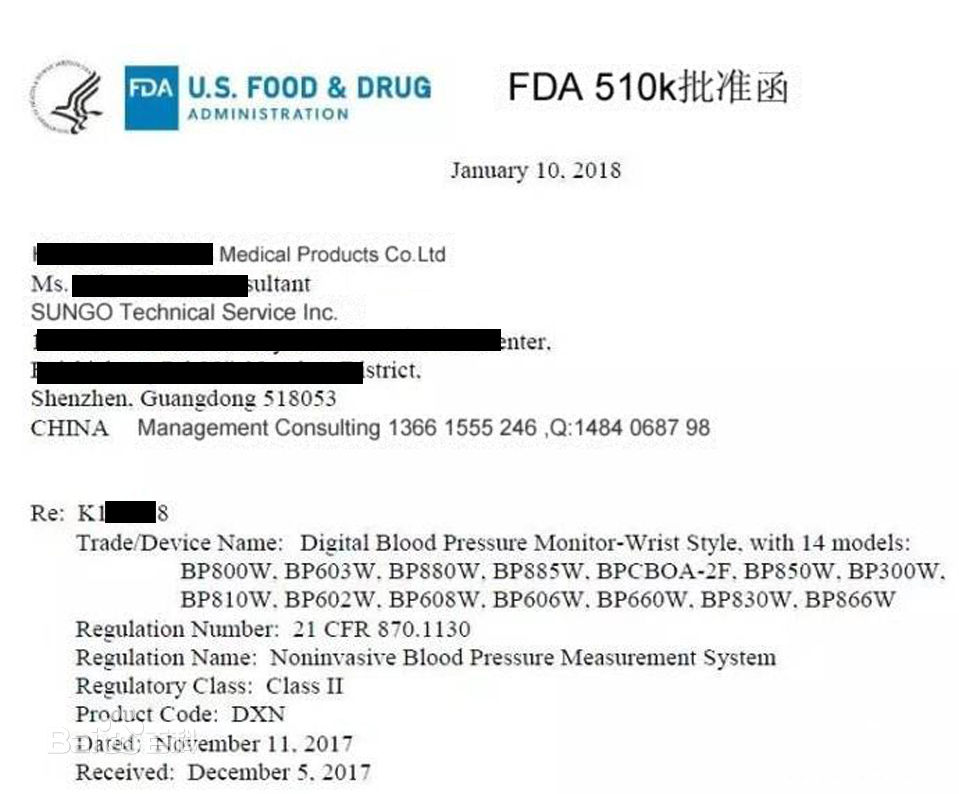
一、510K指的是FDA法规里面的一个,讲的是PMN,也就是Pre Market Notification 上市前通告。
510(k)文件是向FDA递交的上市前申请文件,目的是申请上市的器械与不受上市前批准(PMA)影响的合法上市器械同样*有效,即为等价器械(substantially equivalent)。申请者必须把申请上市的器械与现在美国市场上一种或多种相似器械对比,得出并且支持等价器械的结论。
二、医疗器械FDA认证流程
一类医疗器械,并且是豁免510K的产品,流程比较简单,只要申请企业注册和产品注册即可,没什么复杂的。
II类医疗器械,并且不豁免510K的产品,流程稍微复杂一点,先要准备产品技术资料、产品工艺资料、产品参数资料、产品结构资料、产品测试数据等。有了这些资料,我们就可以撰写510K报告。撰写好510K报告,就要提交给FDA或第三方机构审核,审核通过后,就会取得一个510K代码,有了这个代码,就可以申请产品注册了,工厂注册随时可以申请。
大致流程就是:准备资料--撰写510K报告--510K报告提交机构审核--取得510K代码--产品注册和工厂注册--取得产品注册码和工厂注册码。
三、医疗器械FDA所需资料
对于I类豁免510K的医疗器械,做FDA注册相对比较简单,只要提供申请人信息(包括公司名称、地址、电话、联系人、邮箱、网站等)和产品英文名称即可,要是能多提供一些产品信息自然更好.
对于II类医疗器械,撰写FDA510K报告需要准备的资料比较多,大致的内容如下:
(1) 申请函,此部分应包括申请人(或联系人)和企业的基本信息、510(K)递交的目的、申请上市器械的名称型号和分类资料、进行实质等效比较的产品(Predicate Device)名称及其510(K)号码;
(2) 目录,即510(K)文件中所含全部资料的清单(包括附件)
(3) 真实性保证声明,对此声明,FDA有一个标准的样本;
(4) 器材名称,即产品通用名、FDA分类名、产品贸易名;
(5) 注册号码,如企业在递交510(K)时已进行企业注册,则应给出注册信息,若未注册,也予;
(6) 分类,即产品的分类组、类别、管理号和产品代码;(7) 性能标准,产品所满足的强制性标准或自愿性标准;
(8) 产品标识,包括企业包装标识、使用说明书、包装附件、产品标示等;
(9) 实质相等性比较(SE);
(10) 510(K)摘要或声明;
(11) 产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等;
(12) 产品的*性与有效性,包括各种设计、测试资料;
(13) 常规测试项目: 生物相容性;产品性能。
(14) 色素添加剂(如适用);
(15) 软件验证(如适用);
(16) 灭菌(如适用),包括灭菌方法的描述、灭菌验证产品包装和标识等。
四、FDA510K评审周期
Day 1:FDA receives 510(K) submission
↓
By Day 7
FDA sends Acknowledgement Letter.
OR
FDA sends Hold Letter if unresolved issues with User Fee and/or eCpoy.
↓
By Day 15:
FDA conducts Acceptance Review.
FDA informs submitter if 510(K) is accepted for Substantive Review or placed on RTA Hold.
↓
By Day 60:
FDA conducts Substantive Review.
FDA communicates via a Substantive Interaction to inform the sunmitter that the FDA will either proceed with Ineractive Review or that 510(K) will be placed on hold and Additional Information is required.
↓
By Day 90:
FDA sends final MDUFA Decision on 510(K).
↓
By Day 100:
If MDUFA Decision is not reached by Day 100,FDA Provides Missed MDUFA Decision Communication that identifines outstanding review issues.
我们的服务
预申请策略建议
根据产品的特性确定合适的对比器械
根据我们的经验,为您的应用开发解决方案
推荐合适的检测机构
需要各种类型的信息来协助编写510(k)文件
为您编写FDA 510(k)文件
提供代表与的审查机构进行沟通
协助完成工厂注册和医疗器械列示
美国代理人服务
FDA审核、QSR820体系建立
http://fdasungo.b2b168.com
欢迎来到上海沙格医疗科技有限公司网站, 具体地址是上海市浦东新区上海市浦东新区世纪大道1500号14楼,老板是张小姐173-2126-1042。
主要经营上海沙格医疗科技有限公司(电话:*)致力于为**的生产商和经营者提供市场准入的合规咨询以及注册服务。服务包含:FDA认证、FDA注册、ISO13485认证、欧盟授权代表、fda510k认证、MDRCE认证。十多年里,SUNGO已为**30多家上市公司和**制造商,合计5000多家企业提供过相关服务。
。
单位注册资金单位注册资金人民币 500 - 1000 万元。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:FDA认证,FDA注册,欧盟授权代表,fda510k认证,MDRCE认证等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们较大的收益、用户的信赖是我们较大的成果。